Quá trình nghiên cứu của RenaProtect
Trong những năm gần đây, tỷ lệ mắc bệnh thận mãn tính cao và sự phổ biến rộng rãi đã khiến việc chăm sóc sức khỏe thận trở thành vấn đề được quan tâm toàn cầu. Đài Loan, với tỷ lệ mắc bệnh thận giai đoạn cuối đứng đầu thế giới, nổi tiếng là "vương quốc thận"[1]. Hiện tại, cứ mười người dân thì có một người đã mắc bệnh thận mãn tính. Cơ quan Bảo hiểm Y tế công bố số người đang chạy thận nhân tạo đã vượt qua 90.000, lập kỷ lục mới[2]. Chi phí y tế cho bảo hiểm y tế cũng đứng đầu nhiều năm, đạt 51,3 tỷ NDT, là vấn đề y tế nan giải của xã hội Đài Loan.
Tỷ lệ mắc bệnh thận mãn tính vẫn tiếp tục tăng hàng năm mà không có cách phòng ngừa và điều trị hiệu quả. Hiện nay, rất cần các phương pháp phòng ngừa hoặc hỗ trợ điều trị nhằm duy trì chất lượng cuộc sống cho bệnh nhân, giảm tốc độ xấu đi của bệnh và cung cấp chăm sóc sức khỏe thận hiệu quả. Gần đây, mối quan hệ giữa chuyển hóa của vi khuẩn đường ruột và bệnh thận mãn tính ngày càng được chú ý. Việc ứng dụng probiotics để giảm độc tố urê, cải thiện bệnh thận mãn tính và nâng cao chất lượng cuộc sống của bệnh nhân đã cho thấy hiệu quả đáng kể. Tuy nhiên, trong nước vẫn thiếu các loại probiotics chuyên dụng cho thận để đáp ứng nhu cầu trên. Đại học Quốc gia Đài Loan đã nghiên cứu và phát triển thành công probiotics chức năng LM với mục tiêu này.
Bệnh thận mãn tính phải kiểm soát độc tố urê
Bệnh thận mãn tính được định nghĩa là bất thường về cấu trúc hoặc chức năng thận kéo dài hơn ba tháng. Khi chức năng thận suy giảm, độc tố urê sẽ tích tụ trong cơ thể, gây ra hội chứng urê huyết. Không chỉ gây tổn thương các cơ quan trong cơ thể, dẫn đến viêm mãn tính, mà còn đẩy nhanh sự tiến triển của bệnh thận mãn tính và liên quan mật thiết đến tỷ lệ tử vong do bệnh tim mạch.
Độc tố urê được chia thành ba loại theo đặc tính sinh lý và hóa học: hợp chất hòa tan trong nước phân tử nhỏ, hợp chất phân tử trung bình và hợp chất ưa protein phân tử nhỏ. Trong đó, độc tố urê ưa protein phân tử nhỏ đã được chứng minh gây tổn thương tế bào, phản ứng viêm và đẩy nhanh sự xấu đi của bệnh thận mãn tính. Các chất này gồm sulfate indoxyl (Indoxyl sulfate, IS) và p-Cresyl sulfate (PCS). Khi chức năng thận càng kém, nồng độ sulfate indoxyl và p-Cresyl sulfate trong máu càng cao[3]. Sự hình thành hai chất độc urê này liên quan chặt chẽ đến vi khuẩn đường ruột. Protein trong chế độ ăn của chúng ta được tiêu hóa và phân hủy thành các amino acid như tryptophan, phenylalanine và tyrosine. Các vi khuẩn đường ruột như E. coli sẽ chuyển hóa chúng thành các tiền chất của độc tố urê, tức là indole và p-Cresol. Sau đó, chúng được hấp thụ qua niêm mạc ruột, chảy vào gan và chuyển thành sulfate indoxyl và p-Cresyl sulfate, đi vào hệ tuần hoàn máu và ảnh hưởng đến các cơ quan như thận. Do đó, kiểm soát độc tố urê phải bắt đầu từ "ruột".
Bệnh thận mãn tính gây mất cân bằng trục ruột-thận, dẫn đến sản xuất nhiều độc tố urê
Bệnh nhân mắc bệnh thận mãn tính do suy giảm chức năng thận không thể loại bỏ độc tố, cộng với các yếu tố như hạn chế ăn uống và dùng thuốc, làm mất cân bằng hệ vi khuẩn đường ruột (Dysbiosis). Nghiên cứu cho thấy sự đa dạng và phong phú của vi khuẩn đường ruột ở bệnh nhân viêm cầu thận giảm đáng kể, xuất hiện hiện tượng mất cân bằng vi khuẩn đường ruột. Các vi khuẩn có lợi như Bifidobacterium và Lactobacillus giảm, trong khi các vi khuẩn phân hủy protein gây hại (pathobionts) như Clostridium và E. coli tăng[4]. Các nghiên cứu khác chỉ ra rằng, ở bệnh nhân giai đoạn cuối của bệnh thận, sự gia tăng vi khuẩn đặc hiệu sản sinh độc tố urê trong ruột là nguyên nhân chính dẫn đến tăng lượng độc tố urê[5].
Mất cân bằng hệ vi khuẩn đường ruột cũng làm hỏng các kết nối chặt chẽ giữa các tế bào biểu mô đại tràng và giảm tỷ lệ sống sót của các tế bào biểu mô, gây ra hội chứng rò rỉ ruột (Gut leak syndrome). Khi hàng rào bảo vệ của ruột bị hỏng, vi khuẩn và độc tố dễ dàng xâm nhập vào cơ thể, gây ra một loạt các phản ứng viêm[6], làm tổn thương thêm các cơ quan như thận, tim mạch, và hệ miễn dịch.
Do đó, mất cân bằng hệ vi khuẩn đường ruột và sự mất cân bằng "trục ruột-thận" trực tiếp trong bệnh thận mãn tính có thể giải thích nguồn gốc của hội chứng urê huyết toàn thân. Nếu không kiểm soát, nó có thể dẫn đến sự tích tụ của các độc tố đặc hiệu và phá hủy các tế bào biểu mô của thành ruột, xâm nhập vào hệ tuần hoàn máu, tăng gánh nặng cho thận và đẩy nhanh sự xấu đi của bệnh thận mãn tính[7].
Liệu pháp hỗ trợ bệnh thận mãn tính - Phát triển probiotics thận LM
Probiotics có khả năng cải thiện thành phần và sự ổn định của hệ vi khuẩn đường ruột, do đó có tiềm năng cao trở thành chiến lược chăm sóc sức khỏe hiệu quả cho bệnh thận mãn tính. Kết quả thí nghiệm trên người hiện tại cho thấy việc sử dụng probiotics có thể giảm lượng độc tố urê, tăng tỷ lệ vi khuẩn có lợi trong hệ vi khuẩn đường ruột, không chỉ cải thiện triệu chứng khó chịu của đường ruột mà còn có tác dụng tích cực trong việc làm chậm tiến triển của bệnh thận[8,9,10].
Do hiện tại trong nước thiếu các probiotics chuyên dụng cho thận có thể nhắm mục tiêu giảm độc tố urê, nhóm nghiên cứu của chúng tôi đã sử dụng công nghệ bằng sáng chế để phát triển một chủng probiotics mới, có khả năng giảm các tiền chất độc tố urê trong ruột, có hiệu quả trong việc làm chậm suy giảm chức năng thận. Probiotics này có thể được sử dụng như một thực phẩm chức năng phòng ngừa hoặc hỗ trợ điều trị bệnh thận mãn tính. Các bước phát triển và kết quả thí nghiệm như sau[11]
(I) Bước một: Sàng lọc, tinh lọc và nhận diện chủng vi khuẩn
Sàng lọc chủng vi khuẩn là bước quan trọng nhất quyết định hiệu quả của thực phẩm chức năng probiotics. Nhóm nghiên cứu của chúng tôi đã phát triển một môi trường nuôi cấy mô phỏng đường ruột in vitro, đặc biệt để sàng lọc nhanh các chủng vi khuẩn tiềm năng đối với tiền chất của độc tố urê như indole và p-Cresol. Sau đó, chúng tôi tiến hành nhận diện các chủng vi khuẩn thông qua trình tự gene 16S rRNA và gene nội bộ để xác nhận danh tính của các chủng tiềm năng.
Đồng thời, probiotics phải có khả năng chịu được axit dạ dày và kháng lại mật, để sau khi qua hệ tiêu hóa vẫn giữ được một số lượng vi khuẩn sống nhất định mới có thể phát huy tác dụng cải thiện sức khỏe. Do đó, cần phải đánh giá khả năng chịu đựng môi trường dạ dày và ruột của các chủng tiềm năng, bằng cách sử dụng dịch mô phỏng tiêu hóa có chứa enzyme tiêu hóa để đánh giá khả năng chịu đựng trong môi trường ruột.
(II) Bước hai: Thử nghiệm tỷ lệ phối trộn các chủng probiotics
Nhóm nghiên cứu của chúng tôi tiếp tục kết hợp các chủng tiềm năng đã được sàng lọc, đánh giá khả năng giảm tiền chất độc tố urê trong môi trường mô phỏng đường ruột của các tổ hợp khác nhau. Chúng tôi chọn ra hai chủng vi khuẩn có hiệu quả tốt nhất là Lactobacillus paracasei MFM 18 và Lactobacillus plantarum MFM 30-3 để kết hợp và đặt tên là công thức LM (Lactobacillus Mix).
(III) Bước ba: Đánh giá hiệu quả cải thiện bệnh thận mãn tính của probiotics LM trên động vật
Sau khi lựa chọn công thức LM, nhóm nghiên cứu tiến hành thử nghiệm trên chuột bị bệnh thận mãn tính để xác minh khả năng cải thiện triệu chứng của probiotics LM, đánh giá xem liệu có thể làm chậm tiến triển của bệnh thận mãn tính hay không. Thí nghiệm chia động vật ngẫu nhiên thành ba nhóm: nhóm đối chứng, nhóm bệnh thận mãn tính và nhóm bệnh thận mãn tính được cho ăn probiotics LM. Trước khi gây bệnh thận mãn tính, chúng tôi cho chuột ăn probiotics LM trong hai tuần. Sau hai tuần, tiếp tục cho ăn thức ăn chứa 0,2% adenine trong 17 ngày để gây bệnh thận mãn tính. Sau khi hoàn tất, thay thức ăn bình thường không chứa chất gây bệnh.
Đánh giá thí nghiệm trên động vật cho thấy, so với nhóm đối chứng khỏe mạnh có thận mịn màng và màu đỏ tươi, nhóm bệnh thận mãn tính có thận nhăn nheo và màu nhạt. Các chỉ số chức năng thận như nitơ urê máu và creatinine trong máu của nhóm bệnh thận mãn tính tăng đáng kể, cho thấy sự suy giảm chức năng thận. Phân tích mô bệnh học cho thấy, nhóm bệnh thận mãn tính có các dấu hiệu xấu đi rõ rệt như thâm nhập bạch cầu, xơ hóa, ống thận giãn rộng, thoái hóa, hoại tử và lắng đọng tinh thể; khoảng trống Bowman cũng giãn rộng, thể hiện các đặc điểm bệnh lý tương tự bệnh thận mãn tính (Hình 1).
(IV) Kết quả thí nghiệm cải thiện bệnh thận mãn tính của probiotics LM
- Cải thiện chỉ số chức năng thận trong máu: Nhóm chuột được cho ăn probiotics LM giảm đáng kể chỉ số nitơ urê máu (BUN), và có xu hướng giảm chỉ số creatinine.
- Làm chậm sự suy giảm chức năng mô thận: Phân tích mô bệnh học cho thấy, probiotics LM làm giảm đáng kể các dấu hiệu xấu đi của bệnh lý thận như thâm nhập bạch cầu, xơ hóa, giãn rộng ống thận, thoái hóa, hoại tử và lắng đọng tinh thể; khoảng trống Bowman cũng giảm giãn rộng. Thử nghiệm phân tích mức độ xơ hóa mô cũng cho thấy probiotics LM giảm diện tích xơ hóa. Kết quả này cho thấy, probiotics LM có thể làm chậm tiến triển bệnh thận và giảm mức độ xơ hóa, giúp duy trì chức năng thận tốt hơn.
- Giảm stress oxy hóa: Phân tích chỉ số stress oxy hóa cho thấy, mặc dù probiotics LM không thể thay đổi mức tiêu thụ glutathione do bệnh thận mãn tính gây ra, nhưng có thể phục hồi sự biến đổi của enzyme superoxide dismutase và glutathione peroxidase do bệnh thận mãn tính gây ra, thể hiện xu hướng tương tự như nhóm khỏe mạnh.
- Giảm phản ứng viêm thận: Phân tích các chỉ số viêm liên quan đến mô thận cho thấy, nhóm chuột được cho ăn probiotics LM giảm biểu hiện protein của enzyme myeloperoxidase gây viêm, và điều chỉnh mức cytokine TNF-alpha và IL-6 trở lại mức tương tự như nhóm đối chứng khỏe mạnh.
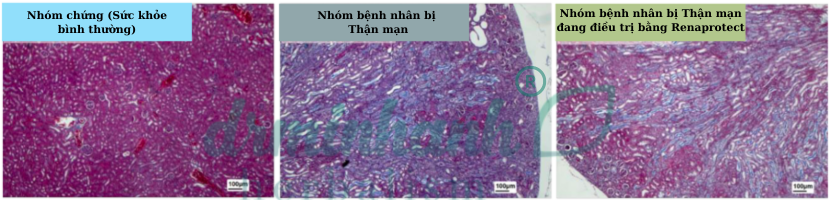
Hình 1. Hiện tượng xơ hóa thận trong nhóm bệnh thận so với nhóm đối chứng khỏe mạnh và hiệu quả của probiotics LM
Trong hình cắt lát thận, nhóm bệnh thận so với nhóm đối chứng khỏe mạnh cho thấy hiện tượng xơ hóa rõ rệt. Việc sử dụng probiotics LM có thể giảm đáng kể diện tích xơ hóa lên đến 13% (#p<0.05)
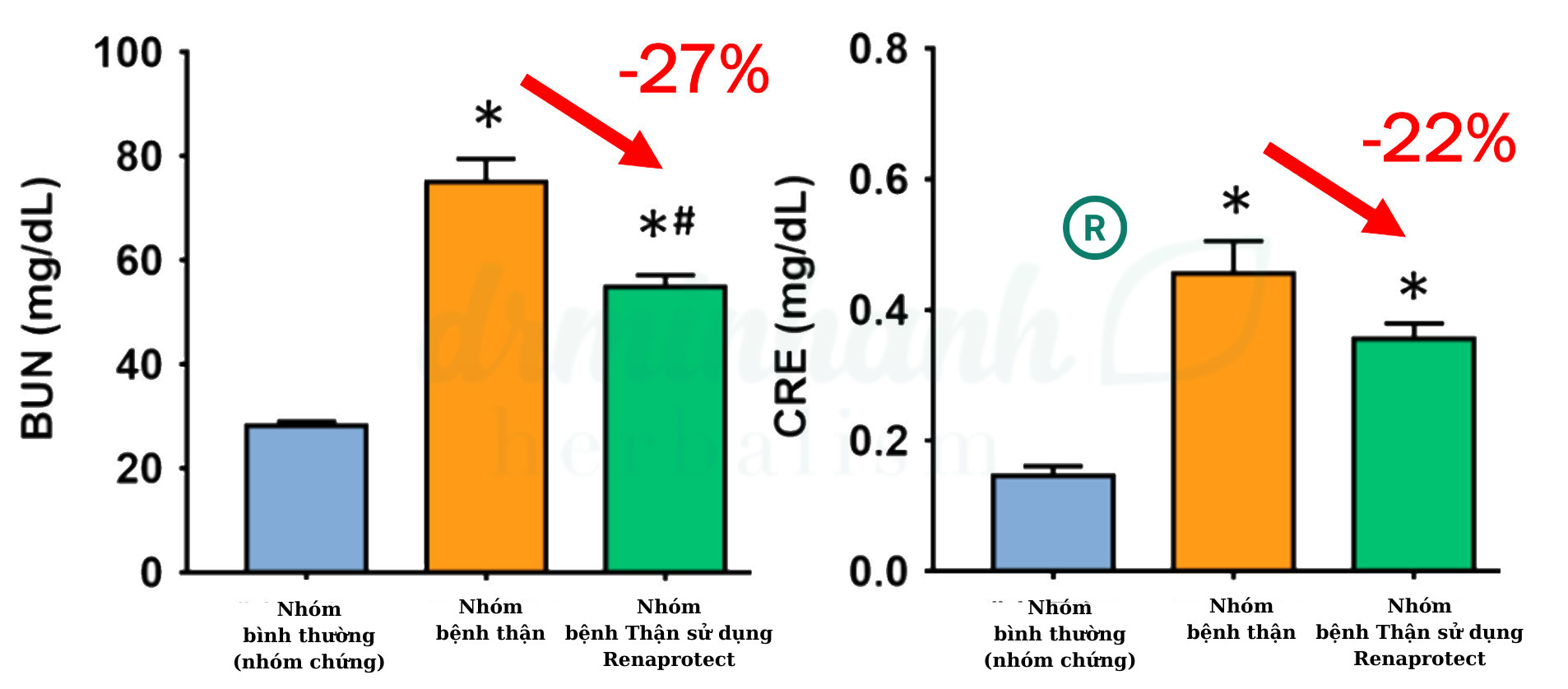
Hình 2. So sánh chỉ số BUN và creatinine giữa nhóm bệnh thận và nhóm đối chứng khỏe mạnh, cùng với hiệu quả của probiotics LM
Nhóm bệnh thận có chỉ số BUN (nitơ urê máu) và creatinine cao hơn so với nhóm đối chứng khỏe mạnh (*p<0.05). Việc sử dụng probiotics LM có thể giảm đáng kể chỉ số BUN trong máu (#p<0.05), và chỉ số creatinine cũng có xu hướng giảm.
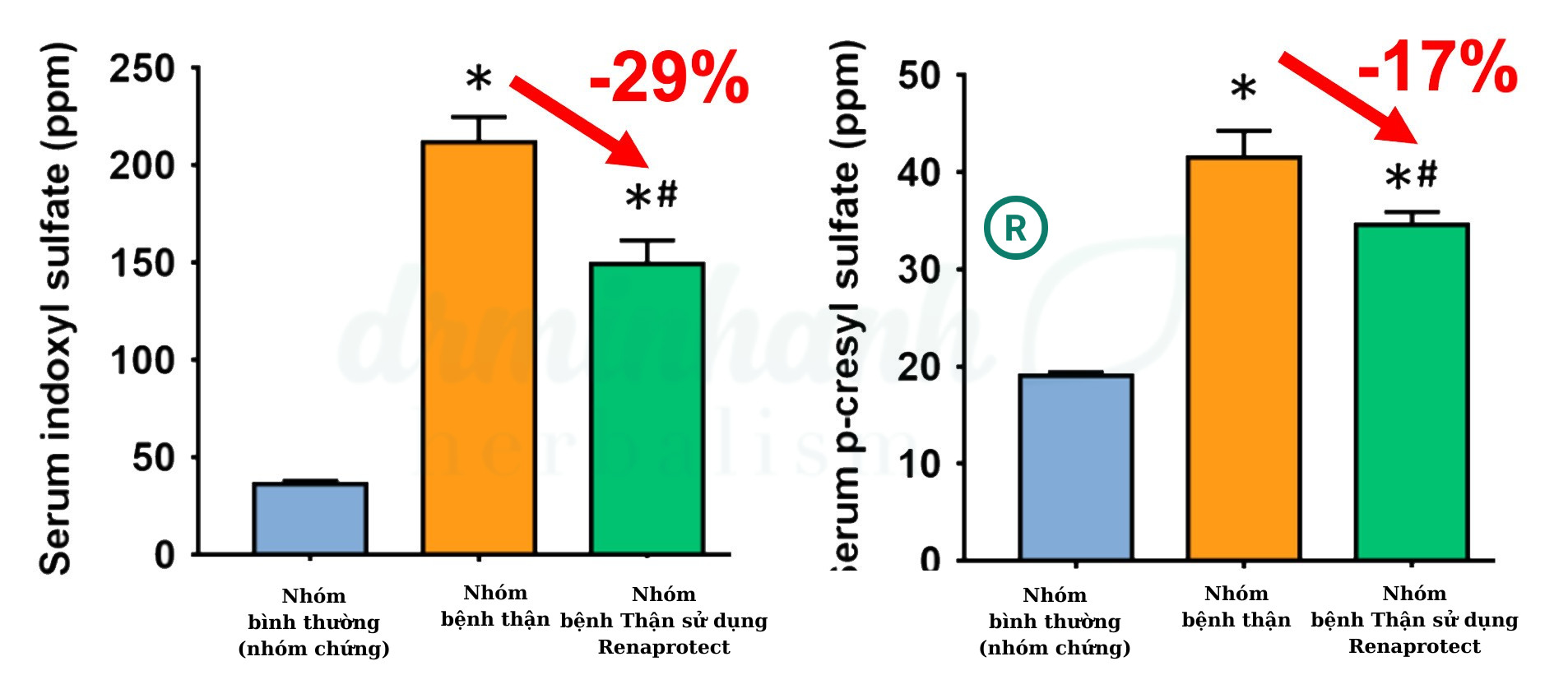
Hình 3. So sánh nồng độ độc tố urê trong máu giữa nhóm bệnh thận và nhóm đối chứng khỏe mạnh, cùng với hiệu quả của probiotics LM
Nhóm bệnh thận có nồng độ độc tố urê trong máu cao hơn so với nhóm đối chứng khỏe mạnh (*p<0.05). Việc sử dụng probiotics LM có thể giảm đáng kể nồng độ độc tố urê trong máu (#p<0.05).
Phân tích cơ chế tác động của probiotics LM
Phân tích sâu hơn về cơ chế tác động cho thấy probiotics LM có thể:
- Giảm đáng kể hàm lượng độc tố urê trong máu, cụ thể là sulfate indoxyl và p-Cresyl sulfate.
- Tăng cường khả năng hàng rào bảo vệ của ruột, giảm tính thấm của ruột.
- Tăng hàm lượng axit béo chuỗi ngắn, đặc biệt là axetat, trong phân.
Do đó, có thể suy luận rằng việc sử dụng probiotics LM có thể thay đổi hệ vi sinh vật đường ruột, điều chỉnh sự cân bằng của hệ vi sinh vật này, duy trì khả năng bảo vệ của hàng rào ruột, giảm nồng độ độc tố urê trong máu, và từ đó giảm sự tích tụ của các chất độc hại gây tổn thương mô thận. Điều này giúp cải thiện tình trạng stress oxy hóa và viêm do bệnh thận mãn tính, giúp thận duy trì chức năng tốt hơn
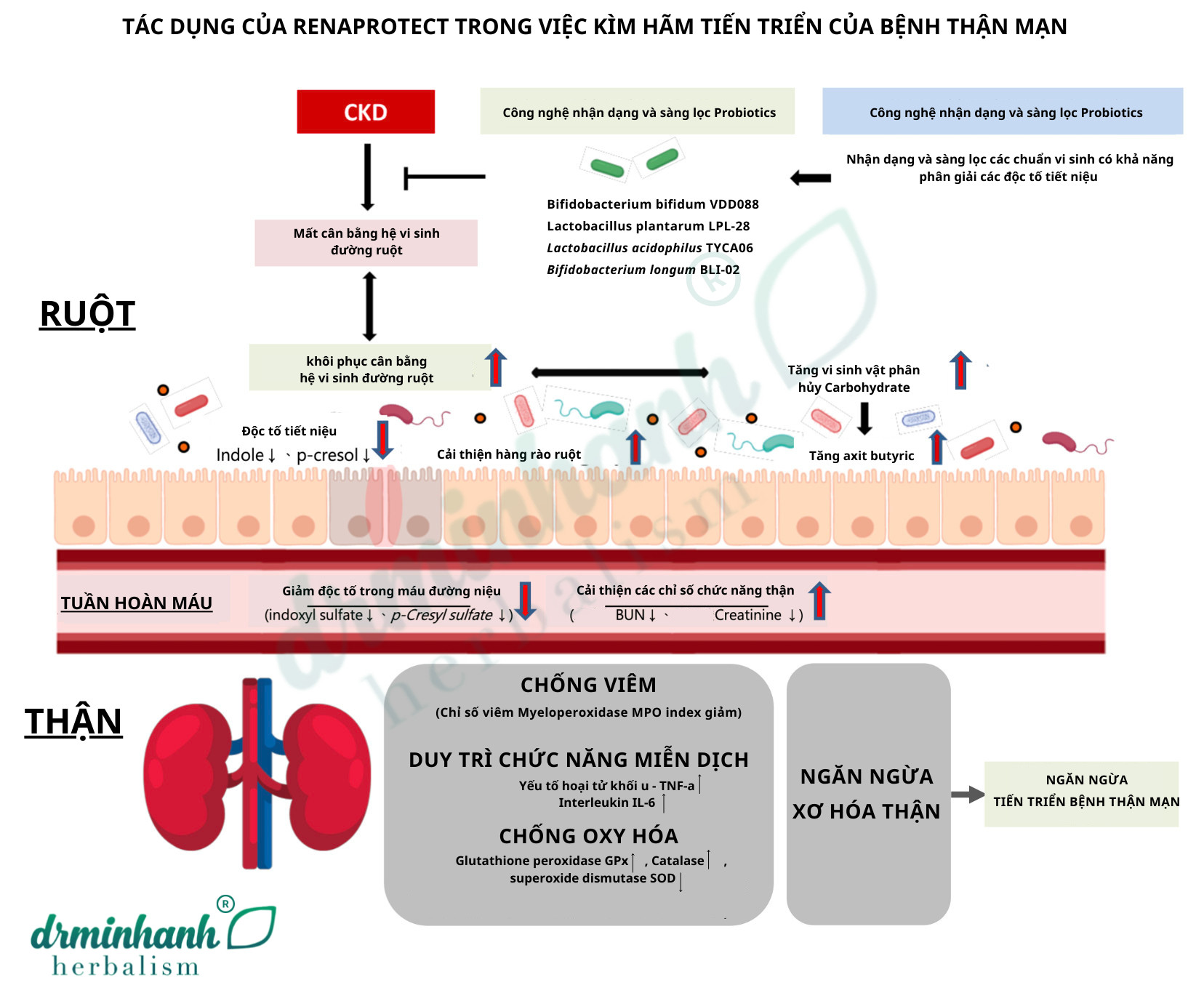
Triển vọng tương lai của việc ứng dụng probiotics LM trong chăm sóc sức khỏe thận
Bệnh thận mãn tính là vấn đề sức khỏe được quan tâm trên toàn cầu. Probiotics LM mà nhóm nghiên cứu chúng tôi đã sàng lọc có thể can thiệp vào trục ruột-thận, bằng cách hấp thụ hoặc chuyển hóa các tiền chất độc tố urê trong đường ruột, điều chỉnh thành phần vi sinh vật đường ruột và giảm stress oxy hóa, từ đó giảm tổn thương thận và làm chậm quá trình phát triển của bệnh thận. So với các phương pháp điều trị bệnh thận mãn tính hiện nay, việc sử dụng "probiotics chuyên dụng cho thận" như một thực phẩm chức năng để phòng ngừa hoặc hỗ trợ điều trị có thể cung cấp một liệu pháp vi sinh vật hiệu quả và không có tác dụng phụ, góp phần phát triển các loại thực phẩm chăm sóc sức khỏe. Probiotics LM có tiềm năng lớn trong việc phòng ngừa và làm chậm quá trình tiến triển của bệnh thận, giúp cộng đồng hướng tới một cuộc sống khỏe mạnh và lợi thận.
Tài liệu tham khảo:
- Jankowski J, Floege J, Fliser D, et al. Cardiovascular disease in chronic kidney disease pathophysiological insights and therapeutic options. Circulation. 2021;143:1157–1172.
- 2021台灣腎病年報
- Briskey, D. Tucker, P., Johnson, D. W. and Coombes, J. S. (2017) The role of the gastrointestinal tract and microbiota on uremic toxins and chronic kidney disease development. Clinical and Experimental Nephrology 21: 7-15.
- De Angelis, M., Montemurno, E., Piccolo, M., Vannini, L., Lauriero, G., Maranzano, V., Gozzi, G., Serrazanetti, D., Dalfino, G., Gobbetti, M. and Gesualdo. L. (2014) Microbiota and metabolome associated with immunoglobulin A nephropathy (IgAN). PLoS One. 9:
e99006. - Wong, J., Piceno, Y. M., DeSantis, T. Z., Pahl, M., Andersen, G. L. and Vaziri. N. D. (2014) Expansion of urease- and uricase- containing, indole- and p-cresol-forming and contraction of short-chain fatty acid-producing intestinal microbiota in ESRD. American Journal of Nephrology 39: 230-237.
- Koppe, L., Mafra, D. and Fouque, D. (2015) Probiotics and chronic kidney disease. Kidney International 88: 958-966.Sampaio-Maia et al., 2016 < The Oral Microbiome in Health and Its Implication in Oral and Systemic Diseases >
- Sampaio-Maia, B., Simões-Silva, L., Pestana, M., Araujo, R. and Soares-Silva, I. J. (2016) The role of the gut microbiome on chronic kidney disease. Advances in Applied Microbiology 96: 65-94.
- Hida, M., Aiba, Y., Sawamura, S., Suzuki, N., Satoh, T. and Koga, Y. 1996. Inhibition of the accumulation of uremic toxins in the blood and their precursors in the feces after oral administration of Lebenin, a lactic acid bacteria preparation, to uremic patients undergoing hemodialysis. Nephron. 74: 349-355.
- Ranganathan, N., Friedman, E. A., Tam, P., Rao, V., Ranganathan, P. and Dheer. R. 2009. Probiotic dietary supplementation in patients with stage 3 and 4 chronic kidney disease: a 6-month pilot scale trial in Canada. Current Medical Research and Opinion 25:1919-1930.
- Viramontes-Hörner, D., Márquez-Sandoval, F., Martín-del-Campo, F., Vizmanos-Lamotte, B., Sandoval-Rodríguez, A., Armendáriz-Borunda, J., García-Bejarano, H., Renoirte-López, K. and García-García, G. (2015) Effect of a symbiotic gel (Lactobacillus acidophilus + Bifidobacterium lactis + inulin) on presence and severity of gastrointestinal symptoms in hemodialysis patients. Journal of Renal Nutrition 25: 284-91.
- Hsiaowen Huang, Kuanyi Li, Yajane Lee, and Mingju Chen. (2021) Preventive Effects of Lactobacillus Mixture against Chronic Kidney Disease Progression through Enhancement of Beneficial Bacteria and Downregulation of Gut-Derived Uremic Toxins. J. Agric. Food Chem. 2021, 69, 7353−7366

- Đại học Y dược Tp Hồ Chí Minh
- Viện Đông Y Hiện Đại Dr Minh Anh
- Chuyên gia Y học cổ truyền chuyên sâu
.png)